LA SCIENZA
DEL BUCO DELL’OZONO
(Belviso)
E’ evidente che l’attività
umana ha avuto maggiore interesse sullo strato dell’ozono
negli ultimi vent’anni, sin da quando gli scienziati hanno
dichiarato che l’emissione di clorofluorocarburi nell’atmosfera
può ridurre la quantità di ozono sulle nostre teste.
La presenza di questi Gas (componenti
di clorina) fu scoperta nella stratosfera.
La scoperta del buco dell’ozono
fu subito collegata all’incremento di questi componenti di
clorina. La perdita dell’ozono non fu limitata solo all’Antartico
– tutt’attorno nello stesso tempo la prima
testimonianza fu prodotta in una diminuzione dell’ozono
sulla popolata media latitudine.
Tuttavia, l’improvvisa
differenza e la quasi totale perdita dell’ozono sull’Antartico
a certe altitudini e la perdita dell’ozono nelle medie
latitudini è molto più lenta in alcuni periodi dell’anno.
Tuttavia, è molto preoccupante
quello che si presenta all’interesse della ricerca
scientifica. Molte di queste scoperte hanno trovato rinforzo da
una varietà di organismi scientifici e investigativi
internazionali tramite satelliti ,aircraft, pallono e stazioni
terrestri, inoltre le implicazioni sono ancora da quantificare e
da valutare.
Una ricetta
per far sparire l’ozono
Per capire come avviene la perdita
dell’ozono e ciò che succede per distruggerne tanto,
bisogna pensare ad una "ricetta". Abbiamo bisogno di
molti ingredienti perché avvenga una perdita di ozono.
Le
caratteristiche speciali della meteorologia polare
Cominciamo a guardare
come si comporta l’atmosfera al di sopra dei poli.
La figura seguente indica schematicamente cosa succede al di
sopra dell’atmosfera durante l’inverno.
 Durante
le notti polari invernali, la luce del polo nord raggiunge il
polo sud.
Durante
le notti polari invernali, la luce del polo nord raggiunge il
polo sud.
Una parte venuta circumpolare si sviluppa al centro di una
stratosfera più bassa.
Quindi i venti polari sono conosciuti come i vortici polari
– ciò ha l’effetto di isolare l’aria al di sopra
delle regioni polari.
Poiché non c’è luce solare, l’aria all’interno
del vortice polare, può diventare molto fredda – così
fredda che si possono formare speciali nubi una volta che la
temperatura dell’aria scende al di sotto di -80°C.
Queste nubi sono chiamate "Nubi
Polari Stratosferiche" (o PSC in breve) ma non sono le nubi
che siamo abituati a vedere nel cielo che sono composte da gocce
di acqua.
Quando la temperatura diventa più
fredda si possono produrre gocce di acqua grandine con l’appoggio
di acido nitrico.
Quindi l’esatta composizione è ancora oggetto di studio.
Quindi PSC solo perché avviene la perdita di ozono.
Così abbiamo i primi ingredienti per la nostra ricetta della
perdita di ozono.
Noi dobbiamo avere:
1- inverno polare che porta alla
formazione del vortice polare che isola l’aria all’interno
si esso.
2- temperature fredde; fredde
abbastanza per la formazione delle nuvole della stratosfera
polare. Nel momento in cui il vortice polare si isola le
temperature persistono.
Processo
chimico che porta all’Impoverimento dell’ozono polare
E’ chiaro che i componenti di
cloro e bromuro determinano l’impoverimento dell’ozono
osservato nel buco dell’ozono al di sopra dell’Antartico
e al di sopra del Polo Nord.
Comunque non è stata chiaramente
ancora spiegata la relativa importanza di cloro e bromuro per la
distruzione dell’ozono in diverse regioni dell’atmosfera.
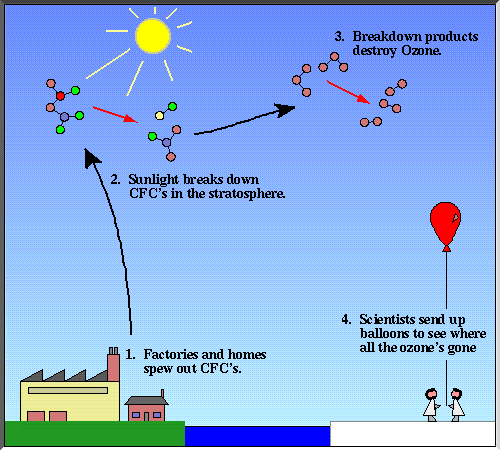
Quasi tutto il cloro e metà del
bromuro sulla stratosfera laddove è stato osservato il maggior
impoverimento, dipende dalle attività umane. La figura di sopre
mostra una schematizzazione del ciclo di vita del CFCs, in che
modo essi sono trapiantati nella stratosfera più alta/più bassa
mesosfera come la luce del sole rompe i componenti e in che modo
i loro prodotti salgono nel vortice polare.
I principali veicoli di cloro (riserve)
inorganici durevoli sono l’acido (HCl) e i nitrati di
clorina (ClONO2).
Quindi si formano dei composti negativi del CFCS.
(N2O5) è
una riserva di ossidi di azoto ed ha un ruolo importante sulla
chimica.
L’acido nitrico(HNO3)
è importante perché mantiene alti livelli di cloro attivo (come
spiegato).
Produzione di radicali di
clorina
Uno dei più importanti punti da
capire sulla chimica del buco dell’ozono e che le reazioni
chimiche più importanti sono insolite.
Esse non possono aver luogo nell’atmosfera
a meno che non si verifichino alcune condizioni: i nostri primi
due ingredienti nelle ricetta della perdita dell’ozono.
La caratteristica centrale di
questa insolita chimica è che HCl e ClONO2 sono trasformati in
forme più attive di clorina sulla superficie delle nuvole della
stratosfera polare. Le più importanti reazioni sulla distruzione
dell’ozono sono:
HCl + ClONO2--->
HNO3 + Cl2 (1)
ClONO2 + H2O
---> HNO3 + HOCl (2)
HCl + HOCl ---> H2O
+ Cl2 (3)
N2O5 + HCl
---> HNO3 + ClONO (4)
N2O5 + H2O
---> 2 HNO3
(5)
E’ importante sapere che
queste reazioni possono aver luogo solamente sulla superficie
delle nuvole della stratosfera polare e sono molto veloci.
Ecco perché il buco dell’ozono è stata una sorpresa.
Reazioni eterogenee (quelle
convengono nella superficie) sono stati tralasciati nei processi
chimici atmosferici (almeno nella stratosfera) fino a che si
scoprisse il buco dell’ozono. Un altro ingrediente, allora
è che questa reazione eterogenea che permette alla riserva di
cloro e bromuro di essere rapidamente trasformate in forme più
attive.
L’acido nitrico (HNO3)
formato in queste reazioni rimane nelle particelle di PSC, cosi
che le concentrazioni gassose di ossido di azoto si riducono.
Questa riduzione, "denoxification",
è molto importante perché rallenta il tasso del ClO che
avrebbe luogo per reazione:
ClO + NO2 + M --->
ClONO2 + M
(6)
(dove M è la molecola dell’aria)
e così si mantengono alti i
livelli di cloro attivo.
Qui ci sono altre informazioni
sulla nostra stratosfera polare.
Questo film mostra una simulazione
tridimensionale di come il ritardo di cloro cambia durante l’inverno
nell’emisfero settentrionale nella stratosfera più bassa.
Ricorda che ClONO2 si
distrugge quando frana (?) il PSCs.
Il sole ritorna nella regione polare al di sopra del sistro
mediano che ClONO2 incomincia a compensare.
Ciò avviene prima intorno al
limite del vortice polare e noi vediamo la classica forma a
ciambella del cosiddetto collare di nitrato di cloro.
Il ritorno
della luce del sole
In ultimo notare che noi abbiamo
formato soltanto il cloro molecolare (Cl2) dalle reazioni (1)-(5).
Per distruggersi l'ozono ha bisogno di cloro atomico.
Il cloro molecolare si foto - dissocia facilmente:
Cl2 + hv -- -> Cl +
Cl
Questa è la chiave per
danneggiare il buco dell'ozono.
Durante l'inverno polare le
temperature fredde che si formano sul vortice portano alla
formazione delle minuscole stratosferiche polari.
Reazioni eterogenee trasformano le
forme di riserve dell’ozono distruggendo le specie di cloro
e bromuro nelle loro forme molecolari.
Quando la luce del sole ritorna
sulle regioni polari dell’emisfero meridionale (autunno nell’emisfero
settentrionale) Cl2 si divide rapidamente in atomi di cloro che
portano l’immediata perdita di ozono.
Questa sequenza di avvenimenti è stata confermata da dati prima,
durante e dopo il buco dell’ozono.
C’è ancora un altro
ingrediente per la nostra ricetta sulla distruzione dell’ozono.
Abbiamo quasi tutto ma non abbiamo
ancora spiegato le reazioni chimiche per cui il cloro atomico
prenda realmente parte alla distruzione dell’ozono. Lo
studieremo in seguito.
Distruzione catalitica
dell’ozono
I dati delle specie chimiche
al di sopra del polo mostrano gli altri livelli di forma attiva
di cloro che abbiamo precedentemente spiegato.
Comunque noi abbiamo molti più atomi di ozono di quanti ne
abbiamo bisogno.
Allora come è possibile
distruggere quasi tutto l’ozono ?
La risposta a questa domanda si trova in ciò che è conosciuto
come "ciclo catalitico".
Un ciclo catalitico è uno in cui
una molecola cambia in modo significativo o rende possibile un
ciclo di reazioni senza essere alterato dal ciclo stesso.
La produzione di cloro attivo
richiede la luce del sole e la luce del sole conduce ai seguenti
cicli catalitici che si pensa siano cicli che coinvolgono il
cloro ed il bromuro, indispensabili per la distruzione dell’ozono.
( I ) ClO + ClO +M --->
Cl2O2 + M
ClO2 + hv --->
Cl + ClO2
ClO2 + M --->
Cl + O2 + M
Quindi: 2 x (Cl + O2
) ---> 2 x (ClO + O2 )
Cioè: 2 O3 --->
3 O2
E
( I I ) ClO + BrO ---> Br
+ Cl +O2
Cl + O3 --->
ClO + O2
Br + O3 --->
BrO + O2
Cioè: 2 O3 --->
3 O2
L’abbassamento ( Cl2O2
) del radicale memorizzato di cloro coinvolto nel ciclo ( I ) è
instabile e il ciclo è più efficace a temperatura bassa.
Queste basse temperature
sono importanti nel vortice polare durante l’inverno. Si
crede che sia responsabile per più del 70 % della perdita dell’ozono
sull’Antartide.
Nell’Artico più trepido una
gran parte della perdita può essere dovuta al ciclo( II ).
In breve per avere la mancanza di
ozono ci vuole:
- L’inverno polare (conduce)
porta alla formazione del vortice polare che isola l’aria
all’interno di esso
- Le temperature fredde all’interno
del vortice, fredde abbastanza per la formazione di
nuvole stratosferiche Polari. Mentre si isola il vortice
d’aria continuano le fredde temperature del PSCs.
- Una volta che si è formato
il PSCs avvengono reazioni eterogenee che trasformano il
cloro inattivo e le riserve di bromuro in forme più
attive di cloro e di bromuro.
- Non avviene nessuna perdita
di ozono fino a che la luce del sole all’interno del
vortice polare è perfetta (la luce del sole) la
produzione di cloro attivo dia inizio alla distruzione
del ciclo catalitico. La perdita di ozono è rapida.
Il buco dell’ozono al momento
copre una regione geografica un po’ più grande dell’Antartico
e si estende per quasi tutta la latitudine nella stratosfera più
bassa.
 Durante
le notti polari invernali, la luce del polo nord raggiunge il
polo sud.
Durante
le notti polari invernali, la luce del polo nord raggiunge il
polo sud.
